近日,国家食品药品监督管理总局发布《2015年度药品检查报告》,公布了2015年药品生产质量管理规范(简称药品GMP)认证检查、GMP跟踪检查、飞行检查等7项检查情况,共计检查企业698家次。其中,药品GMP认证检查数量较前两年有所降低,但药品生产企业的整改率同比提高近一倍。业内专家纷纷表示,药品生产质量监管力度明显加强,一批小、散、乱的药品生产企业逐渐被淘汰,行业整合升级迹象显现。
新版GMP成效明显
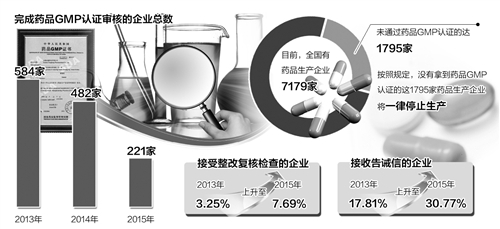
报告显示,2015年国家食品药品监督管理总局食品药品审核查验中心共接收药品GMP认证申报资料221份。其中,完成审核的企业总数由2013年的584家、2014年的482家降至2015年的221家,创下近3年的新低。
“去年完成审核的药品生产企业数量同比下降幅度之所以大,与新版药品GMP认证有密切联系。”国家食药监总局相关负责人介绍说,根据规定,国家食药监总局2011年3月启动了新版药品GMP认证,并要求血液制品、疫苗、注射剂等无菌药品的生产,应在2013年12月31日前达到新版药品GMP要求;其他类别药品的生产均应在2015年12月31日前达到新版药品GMP要求。未通过新版药品GMP认证的企业、生产车间一律停止生产。
在2015年药品GMP认证检查中,共安排检查224家次,其中212家药品生产企业通过检查,9家企业未通过。报告显示,对无菌药品生产风险控制不足、数据可靠性问题、质量管理体系无法保证产品的生产和质量要求等是9家企业未能通过检查的主要因素。
与旧版GMP相比,新版药品GMP认证更接近国际标准,对企业的生产设备和管理水平要求也更高。尤其是对生产环境、设备设施、文件管理、风险控制等一系列流程提出了明确要求,为政府部门监管和保障药品质量安全提供了着力点。
药品监管日趋严格
报告显示,药品GMP认证检查数量较前两年有所降低,但接受整改复核检查和接收告诫信的企业所占比例明显上升,前者由2013年的3.25%上升至2015年的7.69%,后者则由2013年的17.81%上升至2015年的30.77%。
与此同时,《2015年全国收回药品GMP证书情况统计》显示,2015年全国共有140家药企的144张GMP证书被收回。国家食药监总局公布的数据显示,目前,全国有药品生产企业7179家,未通过药品GMP认证的达1795家。按照规定,没有拿到“准生证”的这1795家药品生产企业将一律停止生产。
“新版药品GMP认证实施后,一定程度上促进了医药行业重新洗牌。”中国医药保健品进出口商会副会长刘张林认为,标准严格的认证给药企经营环境带来了更大的考验,有实力的大药企纷纷出招力保拿到“准生证”。
不过,通过药品GMP认证并非意味着可以“一劳永逸”。随着今年药品GMP认证下放到省级食药监局,省级GMP认证检查任务进一步加大,药企也开始面临更多的飞行检查、跟踪检查、抽查检查等运动式检查,监管力度也进一步加强。据不完全统计,截至5月底,通过飞行检查,全国已有52家药企被收回GMP认证证书。
前不久,国家食药监总局食品药品审核查验中心又公布了2016年药品首批GMP跟踪检查的216家企业名单,多个省区市也公布了2016年GMP飞行检查方案和工作重点。“216家企业的名单数量比去年增加了20%的跟踪检查企业数量,而这个数字在2017年很有可能会继续增加,飞行检查的力度还会增强。”天津市市场和质量监督管理委员会认证中心工作人员王守斌表示,今后,飞行检查的力度和严格程度必定会再上一个台阶。
行业将迎整合大潮
目前,严格的飞行检查已经成为药品的常态监管措施。在飞行检查常态化、严格化之后,未通过认证、被直接淘汰的药企数量也随之增加。
“很多未通过药品GMP认证的企业都是小企业,因为无法负担成本而放弃GMP认证,部分中药生产企业直接转做保健品市场,而很多靠生产批号过日子的小企业直接选择退出市场。”北京鼎臣医药管理咨询中心负责人史立臣认为,对于那些拥有多个有价值的药品批文的企业,即使没有通过新版GMP认证,未来也可以与通过认证、实力雄厚的企业并购整合,实现共赢。而对于已经顺利拿到药品GMP认证证书的药企,规范生产、提高药品质量才是根本。
值得注意的是,产能过剩、成本上升等问题始终制约着我国医药行业的发展。当前,我国药品生产企业整体上小、散、乱的格局尚未根本改变,市场上药品同质化现象比较严重,由此造成的生产经营不规范、低水平重复和过度竞争是引发药品质量安全事件的主要原因。
对此,业内专家认为,从行业发展需要来看,新版药品GMP认证能“倒逼”药品生产企业规范产品、提升质量,淘汰落后企业,为行业龙头和上市企业提供更多整合升级的机会。未来,国内药企也不能再依靠低价格低成本竞争,而要在合规的基础上提高药品质量,提升企业竞争力。总之,随着新版药品GMP认证加速推进以及各项政策措施协调配合,我国药品质量安全保障能力将进一步提升。
(责任编辑:金潇)











