据国家药监局网站消息,经河南省食品药品检验所等9家药品检验机构检验,标示为江苏吴中医药集团有限公司苏州制药厂等14家药品生产企业生产的25批次药品不符合规定。现将相关情况通告如下:

一、经河南省食品药品检验所检验,标示为江苏吴中医药集团有限公司苏州制药厂生产的9批次注射用硫酸阿米卡星不符合规定,不符合规定项目为溶液的澄清度与颜色。
经广西壮族自治区食品药品检验所检验,标示为安徽国正药业股份有限公司生产的1批次复方愈创木酚磺酸钾口服溶液不符合规定,不符合规定项目为装量。
经江苏省食品药品监督检验研究院检验,标示为湖南华纳大药厂股份有限公司生产的1批次兰索拉唑肠溶片不符合规定,不符合规定项目为溶出度。
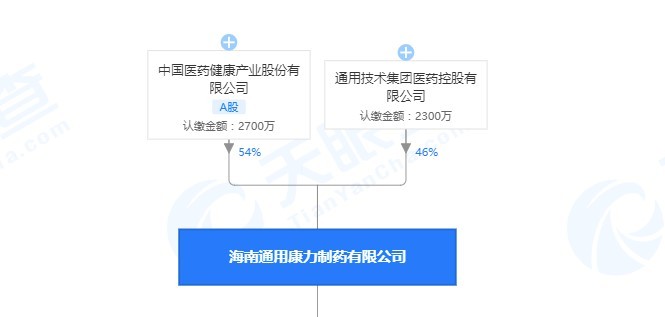
经上海市食品药品检验所检验,标示为海南通用康力制药有限公司生产的4批次注射用奥扎格雷钠不符合规定,不符合规定项目为可见异物。
经湖北省药品监督检验研究院检验,标示为长春人民药业集团有限公司生产的1批次婴儿健脾散不符合规定,不符合规定项目为粒度。
经四川省食品药品检验检测院检验,标示为江西鸿烁制药有限责任公司生产的1批次元胡止痛片不符合规定,不符合规定项目为含量测定;标示为天津同仁堂集团股份有限公司、广东省惠州市中药厂有限公司生产的2批次元胡止痛片检出金胺O。
经中国食品药品检定研究院检验,标示为河北济鑫堂药业有限公司生产的1批次广藿香不符合规定,不符合规定项目为性状。
经安徽省食品药品检验研究院检验,标示为重庆三立堂中药制药有限公司、成都吉安康药业有限公司、内江良辉药业有限公司生产的3批次黄精不符合规定,不符合规定项目为性状。
经大连市药品检验检测院检验,标示为新疆本草堂药业有限公司生产的1批次前胡不符合规定,不符合规定项目为性状。
经中国食品药品检定研究院检验,标示为成都市祺隆中药饮片有限公司生产的1批次制川乌不符合规定,不符合规定项目为性状。
二、对上述不符合规定药品,药品监督管理部门已要求相关企业和单位采取暂停销售使用、召回等风险控制措施,对不符合规定原因开展调查并切实进行整改。
三、国家药品监督管理局要求相关省级药品监督管理部门依据《中华人民共和国药品管理法》,组织对上述企业和单位生产销售假劣药品的违法行为立案调查,并按规定公开查处结果。
天眼查信息显示,江苏吴中医药集团有限公司是A股上市公司江苏吴中实业股份有限公司(简称:江苏吴中 代码:600200)的核心控股子公司,是国家火炬计划吴中医药产业基地的龙头骨干企业。集团主要从事生物药、化学药、现代中药的研发、生产、销售。集团是苏州市医药行业协会会长单位,设有省级企业技术中心,并拥有江苏省唯一的基因药物工程技术中心,成立了博士后科研工作站。集团共有全资和控股企业9家,形成集研发、生产、销售为一体的完整的医药产业链。

海南通用康力制药有限公司专注于高品质注射剂类(冻干粉针剂、无菌粉针剂、小容量水针剂)产品的研发、生产和销售,经过多年的持续积累和创新,现有文号111个,覆盖10多个领域,产品聚焦心脑血管类、全身性抗感染类、能量合剂类,抗肿瘤类四大治疗领域。其中A股上市公司中国医药健康产业股份有限公司(简称:中国医药 代码:600056)持股54%。
湖南华纳大药厂股份有限公司为科创板IPO受理的公司,简称华纳药厂。2001年4月30日,浏阳市华纳大药厂有限公司成立。 2003年1月17日,公司更名为湖南华纳大药厂有限公司。 2015年11月6日,公司整体变更设立股份有限公司,名称变更为湖南华纳大药厂股份有限公司。
公司曾于2016年计划创业板IPO未果,此次转战科创板,拟发行不超过2350万股,募资13.82亿元,用于药物研发项目、年产1000吨高端原料药物生产基地建设一二期续建项目等。公司主营化学原料药、化学药制剂和中药制剂的研发、生产与销售,具备片剂、胶囊、颗粒、散剂、干混悬剂、吸入溶液剂、小容量注射剂、滴眼剂、冻干粉针剂等多种剂型和化学原料药的生产能力。
(责任编辑:朱赫)
