中国网财经7月24日讯(记者 牛荷) 昨日,国家药监局发布的“关于25批次药品不符合规定的通告(2020年第50号)”显示,江苏吴中医药集团有限公司苏州制药厂(“江苏吴中苏州制药厂”)等14家企业生产的25批次药品不符合规定。
不合格的25批次药品,包括注射用硫酸阿米卡星、注射用奥扎格雷钠、黄精、元胡止痛片等。
涉事生产企业包括江苏吴中苏州制药厂、湖南华纳大药厂股份有限公司、安徽国正药业股份有限公司、海南通用康力制药有限公司、长春人民药业集团有限公司等14家企业。
国家药监局表示,对上述不符合规定药品,药品监督管理部门已要求相关企业和单位采取暂停销售使用、召回等风险控制措施,对不符合规定原因开展调查并切实进行整改。同时,要求相关省级药品监督管理部门依据《中华人民共和国药品管理法》,组织对上述企业和单位生产销售假劣药品的违法行为立案调查,并按规定公开查处结果。
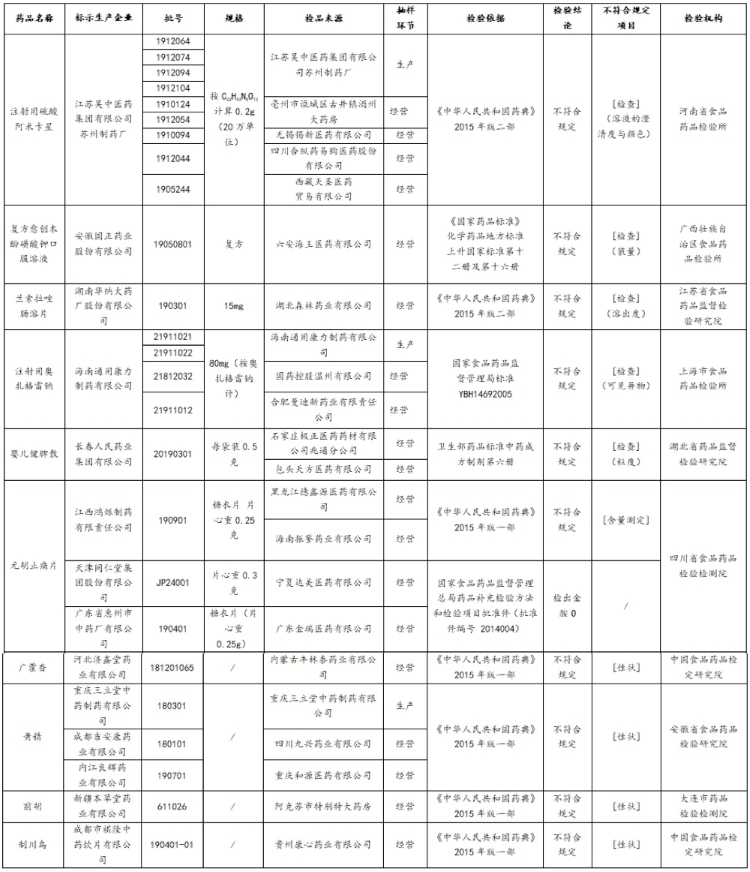
25批次不符合规定药品名单(来源:国家药监局)
记者注意到,此次涉事的生产企业包括江苏吴中(600200.SH)分公司江苏吴中苏州制药厂,该药厂生产的9批次注射用硫酸阿米卡星不符合规定,不符合规定项目为溶液的澄清度与颜色。
此前,江苏吴中曾为此连发公告。
7月3日,江苏吴中公告称,江苏吴中苏州制药厂已暂停生产并主动召回该药品,可能产生的损失、赔偿等情况暂不明确。同时表示,问题批次产品事件发生后,公司立即启动召回程序,发出召回通知,并要求江苏吴中苏州制药厂就产品生产过程进行全面复查并及时完成整改。
此外,江苏吴中表示,2019 年度,江苏吴中苏州制药厂生产的注射用硫酸阿米卡星(0.2g)销售收入887.13万元,占公司2019 年度营业收入0.42%。问题批次产品所涉品种“注射用硫酸阿米卡星(0.2g)”的销售收入占公司整体营业收入比重较小,对公司的正常生产经营未造成实质性影响。
7月13日,江苏吴中公告称,问题批次产品事件发生后,公司积极配合省级药监部门对苏药厂进行调查取证、风险会商会、飞行检查等工作。截至本公告日,江苏吴中苏州制药厂已停止生产、销售该药品,并已启动召回程序,发出召回通知;同时,根据对该产品已使用地区的监测,未收到相关不良反馈。
(责任编辑:牛荷)
