2015版药典的立项启示
- 发布时间:2015-10-09 09:50:50 来源:东方网 责任编辑:吴起龙
由CFDA批准颁布的2015年版《中华人民共和国药典》(简称“2015年版药典”),将于2015年12月1日起正式实施。
2015年版药典重点加强了对药品安全性和有效性的控制要求。药典收录的质量控制技术,可以反映我国当前医药发展和检测技术的现状,并将推动我国药品质量提高,加快企业技术进步和产品升级换代。
药典主要是针对已上市药品的质量标准,因而对已上市药物影响更大。对于研发立项而言,从药典中可以窥探药典委员会对现有药物的一些态度,从而推断项目的可行性。对市场准入而言,药典的行政意义就更大了,虽然药典的质量标准是最低的准入标准,但个别省份的招标政策会允许药典起草单位获得优势。最近湖北的招标方案甚至将药典产品和非药典产品分组。
四部“改剂型”?
定义更科学,更关注临床用量大的剂型,新剂型走向存疑。
2015年版药典比2010年版的三部多了一部,变成四部。第四部其实是在对各部药典共性附录进行整合,将原附录更名为通则,重新建立规范的编码体系后将通则、药用辅料单独作为中国药典第四部。第四部收载通则总计317个,其中制剂通则38个、检验方法240个、指导原则30个、标准物质和试液试药相关通则9个。
第四部的制剂通基本涵括了2010年版三部药典的附录制剂通则,如表1所示,在定义上更是涵括了2010年三部药典附录。
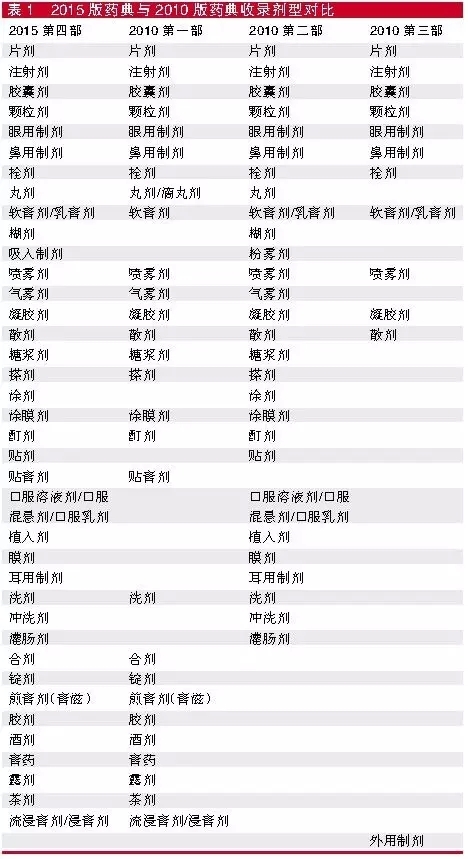
以片剂为例,2010年第一部的附录定义为“片剂系指提取物、提取物加饮片细粉或饮片细粉与适宜辅料混匀压制或用其它适宜方法制成的圆片状或异形片状的制剂”;第二部的定义则是“片剂系指药物与适宜的辅料混匀压制而成的圆片状或异形片状的固体制剂”;第三部的定义为“片剂系指以生物制品原液经干燥后制成的干粉为原料药物,与适宜的辅料混匀压制而成的圆片状或异形片状的固体制剂;该原料药可由一种或多种活性成分组成”。2015年第四部的定义是“片剂系指原料药物或与适宜的辅料制成的圆形或异形的片状固体制剂”。
此定义以“原料药物”精炼了中药的“提取物、提取物加饮片细粉或饮片细粉”和生物药的“生物制品原液经干燥后制成的干粉为原料药物,该原料药可由一种或多种活性成分组成”,并且“或与适宜的辅料”将范围涵括了部分直接原料药制片的产品,取消了“混匀压制而成”的字眼则与时俱进地将片剂工艺限制放开。
事实上,对于改剂型,各职能部门的态度有所不同。CFDA曾表明,对盲目为新药证书或者招标独家剂型而更改剂型行为持限制态度;8月18日发布的《国务院关于改革药品医疗器械审评审批制度的意见》,对具备创新性和临床意义的产品持正向态度的;各地招标办则经常将药典的剂型分类作为招标分组的参考。
第四部将注射剂分为“注射液、注射用无菌粉末与注射用浓溶液等”。其中注射液系指“原料药物或与适宜的辅料制成的供注入体内的无菌液体制剂,包括溶液型、乳状液型或混悬型等注射液”,注射用无菌粉末系指“原料药物或与适宜辅料制成的拱临用前无菌溶液配成注射液的无菌粉末或无菌块状物,一般采用无菌分装或冷冻干燥法制得。以冷冻干燥法制备的生物制品注射用无菌粉末,也可称为注射用冻干制剂”,注射用浓溶液系指“原料药物与适宜辅料制成的供临用前稀释后静脉滴注用的无菌浓溶液”。
以上定义都没有提及目前市场上企业关注的注射剂热点,如注射用干乳剂、脂质体、微球、纳米胶束等,而这些剂型对应的我国上市批文基本都没有超过10个。这些热点注射剂型没有单独细分出来,或许还是与药典更关注临床常用剂型有关。
相较之下,2010年已经上药典的缓释片、控释片和肠溶片顺理成章地进入2015年版药典,此类药品在2010年之后的招标中经常单列。
注射用干乳剂、脂质体和微球能否在未来招标中剂型单列存疑。此外,注射用浓溶液目前只有诺华的注射用唑来膦酸浓溶液1个批文,在符合临床需求的应用下,注射用浓溶液的研发或许是个方向。
新技术促产业淘汰?
药典委员会的态度是:非常慎重而不冒进,充分考虑国情的同时逐步推动产业升级
本版药典在保留以往常规检测方法的基础上,进一步扩大了对新技术、新方法的应用,提高了检测的灵敏度、专属性和稳定性。
药典新收录了液相色谱法-串联质谱法、分子生物学检测技术、高效液相色谱-电感耦合等离子体质谱法等用于中药的质量控制,采用超临界流体色谱法、临界点色谱法、粉末X射线衍射法等用于化药的质量控制,采用毛细管电泳分析测定重组单克隆抗体产品分子大小异构体,采用高效液相色谱法测定抗毒素抗血清制品分子大小分布等。
在检测技术储备方面,建立了中药材DNA条形码分子鉴定法、色素测定法、中药中真菌毒素测定法、近红外分光光度法、基于基因芯片的药物评价技术等指导方法。
值得注意的是,第一部药典新收录的质谱法,更多是用在药材的重金属检测上,制剂实际应用的很少,只有2个产品收录且是应用于重金属检测;而本部药典中药测定方法收录了76种气相色谱-串联质谱法和155种农药的液相色谱-串联质谱法。这宣示国家对中药种植中农药残留过多问题处理的决心,也意味着未来中药材成本会越来越高。
相对中药而言,化药对成分的控制更直接明确。以肝素钠为例,2010年的标准为“每1mg的效价不得少于170单位”,2015年药典则为“以干燥品计算,每1mg抗Ⅱa因子的效价不得少于180IU,抗Xa因子效价与抗Ⅱa因子的效价比应为0.9~1.11”,鉴别和对应的手段提高。
坊间有个说法,通过药典质量标准检查方法的提升,可逃避药品生产工艺的提升,同时可将竞争对手淘汰。譬如当年高效液相仪器的提升就是一次行业升级淘汰。毕竟药典的关注点更多是药品成分含量测定,对药品工艺制造方法的限制有限,更没有评判药品临床有效性的职责。
此前传闻,肝素类药物有可能参照美国新药典核磁共振法的标准,但本次药典最终选择美国旧药典分子排阻色谱法,核磁共振法的仪器成本非常高,国内企业和检验机构未必能立即负担。
可见,药典委员会对质量标准提升的态度是:非常慎重而不冒进,充分考虑国情的同时逐步推动产业升级。
收录新产品?
化药收录重点是临床需求大的产品;生物药支持国产自主创新药,淘汰旧产品
2015年版药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,共计2598种。其中新增440种,修订517种,不收载7种;含“儿”字产品新增13品种,不收载1种。
二部收载化学药品、抗生素、生化药品以及放射性药品等,品种共计2603种,其中新增492种,修订415种,不收载28种。
许多指南用药和销售量较大的药品被新增,如本次新增了艾司奥美拉唑钠(曾用名:埃索美拉唑)、兰索拉唑和奥美拉唾钠的原料药、针剂和肠溶片,泮托拉唑钠肠溶胶囊,雷贝拉唑钠、雷贝拉唑钠肠溶片和雷贝拉唑钠肠溶胶囊等,基本将目前常用的PPI产品都涵括了。这体现本次药典收录产品,除了保证国家基本药物目录品种全覆盖外,临床需求大的产品也是收录重点。
三部收载生物制品137种,其中新增13种,修订105种,不收载6种。
最值得关注的是注射用鼠神经生长因子和尼妥珠单抗注射液,二者被新增入治疗类目录。鼠神经生长因子符合国家对多组分生化药升级的方向,提取纯化等步骤都有严格控制标准。尼妥珠单抗由百泰生物药业研制,适应症为与放疗联合治疗表皮生长因子受体(EGFR)表达阳性的Ⅲ/Ⅳ期鼻咽癌。另一方面,注射用抗人T细胞CD3鼠单抗未被收载。
辅料进入2015年版药典第四部是一个进步,虽然收录的270种药用辅料(其中新增137种、修订97种、不收载2种)还不能满足目前的生产需求,但这意味着,对于我国制剂行业而言,规范辅料势在必行。
- 股票名称 最新价 涨跌幅








